목차
1 개요
- 상평형그림(Phase diagram)
물질의 상(Phase)이 2개 이상 공존하며, 상전이의 평형을 이루고 있는 상태. 상평형그림[1]에서는 두 개의 상이 만나는 계면 위의 선으로 나타난다. 모든 평형 상태가 그러하듯 상평형 역시 상전이의 정반응과 역반응의 속도가 동일하기 때문에 상전이가 멈춘 것처럼 보일 뿐, 실제로는 수많은 구성 성분이 상전이를 계속하고 있다. 일반적으로 상평형은 평형상태라는 의미만 고려하고, 실제로 중요하게 다루는 쪽은 물질이 변화하는 과정인 상전이이와 상에 대한 전반적인 내용을 포함하는 상평형그림이다.
2 계에 따른 구분
상평형이 일어나는 계가 하나의 성분으로 이루어진 단일 성분계인가, 여러 개의 성분으로 이루어진 다성분계인가에 따라서 다르게 표현된다.
2.1 단일 성분계
하나의 성분으로 이루어진 계에서 일어나는 평형이다. 온도나 압력의 변화에 따라 상이 변화하는, 가장 기본적인 형태의 상전이에서의 평형이다.[2] 계를 구성하고 있는 물질이 하나이기 때문에 상평형의 의미가 그 물질이 나타낼 수 있는 상 사이로 제한되어 그나마 간단하게 나타난다. 쉽게 설명하자면 0℃의 물처럼
과
이 공존하고 있는 경우. 온도와 압력에 대한 상평형그림에서는 승화 곡선, 증기 압력 곡선, 융해 곡선 등으로 표현하기도 한다.
2.2 다성분계
계를 구성하고 있는 성분이 둘 이상인 경우에서의 평형이다. 구성 성분의 상이 어떠한 것이냐에 따라서 매우 다양한 상황혼돈의 카오스이 펼쳐지기 때문에 상평형그림에서도 복잡한 형태로 나타나는 것이 일반적이다. 합금과 같은 물질이 이 다성분계에 속하기 때문에 재료공학을 배우는 학생들이 원치 않게 공부해야 하는 이유이다.
다성분계에서의 상평형그림은 몰 분율을 변수로 그리는 것이 일반적이며, 온도나 압력 중 하나를 고정시키고 나머지 하나를 변수로 삼아서 그린다. 성분의 개수가 늘어날 수록 그리기도 힘들고 이해하기도 힘들어진다.
3 상평형그림
상평형그림이란 온도나 압력 등의 여러 변수 하에서 물질의상 사이의 평형 상태를 나타낸 도표이다.이 문서가 개설된 주된 이유 아래 그림은 온도-압력 상평형그림이며, 증기 압력 곡선, 승화 곡선, 융해곡선으로 이루어져 있다. 상평형그림은 클라지우스-클라이페롱식의 적분, 또는 온도와 압력, 조성 조건 하에서 나타나는 상을 실험적으로 측정하여 얻어진다.
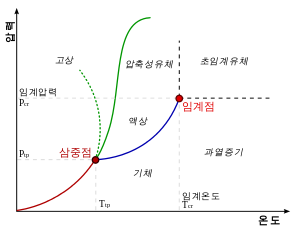
붉은 선은 승화 곡선, 파란 선은 증기 압력 곡선, 녹색 실선은 일반적인 형태의 융해 곡선을 나타낸다. 녹색 점선은 물의 융해 곡선이다.
3.1 증기 압력 곡선
증기 압력 곡선은 일정 온도에서 액체의 증기압을 나타낸 곡선이다. 또한 동적 평형 상태에서 증기압과 외부압력이 같다면 액체가 기화 (또는 기체가 액화)하기 때문에 끓는점을 나타내기도 한다. 따라서 이 선에서는 액체와 기체가 공존할 수 있다. 임계점은 액체와 기체의 경계가 사라지는 곳으로, 이 점 이상의 온도 및 압력이라면 액체와 기체의 특성이 공존하는 초임계유체가 된다.
3.2 융해 곡선
융해 곡선은 특정 기압에서 물체의 녹는점을 표시한 그래프이다. 이 선에서는 고체와 액체가 공존할 수 있다. 증기 압력 곡선의 경우에는 임계점이라는 상한선이 존재하지만, 융해곡선은 그러한 상한이 있는지 밝혀지지 않았다. 일반적으로는 증기압력 곡선과 같이 기울기가 양인 곡선이지만, 물의 경우 기울기가 음인 부분이 있다.
3.3 승화 곡선
일저 온도에서 고체의 증기압을나타낸 곡선으로, 삼중점 이하에서만 존재한다. 위의 곡선들의 특성과 마찬가지로 이 선에서는 액체와 기체가 공존할 수 있다.
3.4 삼중점
세 곡선이 만나는 지점으로, 고체와 액체, 기체의 상이 한 번에 존재할 수 있다. 또한 고체의 경우 다른 결정 구조도 함께 존재할 수 있고, 헬륨의 경우 극저온으로 인해 초유동체[3]도 함께 존재할 수 있다. 또한 삼중점은 1 K의 정의에 사용되기도 한다. 고압에서, 여러 결정 구조를 가지는 고체에서도 삼중점이 생긴다. 다음은 물의 상평형그림이다.[4]

3.5 다성분계의 상평형그림
3.5.1 2성분계
위의 그림들은 비교적 깔끔한(...) 모양의 상평형을 보여주고 있지만, 여러 물질이 섞인 계의 경우 물질끼리 영향을 미쳐 상당히 복잡해진다. 특히 순물질에서도 액체상과 기체상은 단일상만을 가지지만, 고체상은 온도와 압력에 따라 다른 배열을 가짐에 따라 여러가지 고체상을 갖는 경우가 있다. 고용액(Solid Solution)의 경우 고체상이 엄청나게 많이 나타나는 경우도 많다.

철-몰리브덴 합금 상평형그림이다. 합금이 단순히 각 성분의 중간적 성질을 보이지 않는 것은, 이렇게 원자배열구조부터 달라지기 때문이며, 그로부터 생성된 미세조직 역시 큰 차이를 보이기 때문이다. 합금 등 혼합물을 나타나는 계는 압력, 온도, 조성 등 3가지 변수가 있는데, 보통 압력을 고정시키고 온도-조성 그래프로 나타낸다.
하나의 상만 안정적으로 존재하는 영역에는 상 하나의 기호(α, γ, σ 등)만 적혀있고[5], 단일상 영역 사이에 있는 영역은 2개 이상의 상이 동시에 나타나는 부분이다. 몇몇 단일상은 특정한 원자비에만 단일한 상으로 존재할 수 있는데, 이는 상평형그림에서 수직선으로 나타난다. 위의 철-몰리브덴에서는 900°C 이하에서 질량비 0.46 지점에서 람다(λ)로 표시된 Fe2Mo를 찾아볼 수 있고, 철-탄소에서는 질량비 6.7%의 시멘타이트(Fe3C)가 대표적인 예이다.
3.5.2 3성분계
최종보스

3성분계의 상평형은 삼각형 위에 나타낸다.
특정 압력에서의 3성분계 그림으로, 이런 그림을 이해하기에는 공간지각적으로 어렵기 때문에 보통 온도 변수까지도 고정시킨다.

이것이 일반적으로 사용하는 3성분계 상평형그림, 위의 삼각형을 깁스 삼각형(Gibbs Triangle)이라고 하며, 깁스 삼각형은 각 지점에서의 조성을 읽을 수 있게 해 준다. 간단히 말해서, 한 점에서 각 2성분축을 향해 수직선을 내렸을 때, 한 수직선의 높이를 삼각형 변의 길이로 나눈 값이 축에 포함되지 않은 성분의 함량이다.
3.5.3 4성분계
진최종보스
정사면체 내부에 나타내기 때문에 사실상 종이위에 그려서 이해하기는 불가능.그리고 내머리에서도 불가능

- ↑ 상평형보다는 상에 대한 전반적인 것을 담았기 때문에 의미적인 면에서는 오역이 되었다.
- ↑ 고체상에서 결정 구조에 따라 다소 복잡한 형태가 나타나지만...
- ↑ 초임계유체와는 다른 상태로, 극저온 부근에서 점성이 사라져 유체가 벽을 타고 흐르거나 사방으로 흩어지는 물질이다. 이렇게 극저온에서 액체인 물질은 별로 없기 때문에 비교적 최근까지는 그 존재조차 몰랐지만, 1937년 헬륨에서 이 현상이 발견되었다.
- ↑ 얼음은 15개의 결정 구조를 가진다.
- ↑ 알파철(α iron), 감마철(γ)과 같은 용어가 여기에서 비롯되었다.
- ↑ 5성분계는 4면체 5개를 끼워맞춘 정오포체 내부에 나타낸다.