- 관련 항목 : 물리학 관련 정보, 제목이 한글 한 글자인 문서 목록
- 이 문서는 과학에서 쓰이는 열(heat)에 관한 내용입니다. 다른 의미는 열(동음이의어) 문서를 참조해 주세요.
1 개요
열(heat, 熱)이란 계(system)와 주위 환경 사이의 온도 차이 때문에 계의 경계를 넘나드는 에너지의 전달을 뜻한다.
우리가 물질을 가열한다는 것은, 온도가 높은 계에서 낮은 계로 에너지를 전달한다는 것이다. 예를 들어, 용기에 담긴 물을 가열하기 위해 물 속에다 뜨겁게 달군 쇳덩이를 집어넣는 경우를 생각하자. 이때, 온도가 높은 쇳덩이에서 온도가 낮은 물로 에너지가 이동하며, 물과 쇳덩이의 온도가 같아질 때까지 에너지의 이동은 계속 일어날 것이다.(열평형)[1] 즉, 온도가 높은 쇳덩이에서 온도가 낮은 물로 에너지의 전달이 이루어진 것이다. 이러한 에너지의 전달을 열이라고 하는 것이다. 열역학은 이 열과 일에 대해 연구하는 학문이다.
[math]\Delta K + \Delta U + \Delta E_{int} = W + Q + T_{MW} + T_{MT} + T_{ET} + T_{ER}[/math]
이 식은 비고립계에서의 에너지 분석 모형으로, [math]\Delta K[/math]는 운동에너지의 변화량, [math]\Delta U[/math]는 포텐셜에너지의 변화량, [math]\Delta E_{int}[/math]은 내부에너지의 변화량이며, [math]W[/math]는 외부에서 계에 작용한 일, [math]Q[/math]는 열, [math]T_{MW}[/math]는 역학적 파동, [math]T_{MT}[/math]는 물질 이동, [math]T_{ET}[/math]는 전기 송전, [math]T_{ER}[/math]은 전자기 복사이다.
위의 식에서 알 수 있듯이, 열은 에너지의 전달 과정이다. 물질 간의 온도차에 의해 발생한 열이 물질의 에너지를 변화시키는 것이다. 즉, 열은 뜨거운 물질의 에너지가 아니며(뜨거운 물질은 내부 에너지가 큰 것이다), 어떤 환경의 온기가 아니다(이것은 온도가 높은 것이다).
역시 에너지의 전달인 일과 비교했을 때, 열은 에너지의 무질서한 전달이며 일은 에너지의 질서 있는 전달이다. 열을 받은 입자는 무질서한 방향으로 움직이게 된다. 즉 열은 일보다 엔트로피가 높으며, 따라서 열은 일로 자발적으로 전환되지 않는다.
어떤 물질의 온도를 올리는데 필요한 열량은 물질의 특성과 물질의 양에 따라 다르다. 예를 들어, 냄비 속의 물을 1도 올리는 것과 호수 전체의 물을 1도 올리는 데 필요한 열은 확연히 다르다. 또한, 쇳덩어리 1KG과 물 1KG의 온도를 1도 올리기 위한 열 역시 다를 것이다. 물질의 열용량(heat capacity)[math](C)[/math]은 물질의 온도를 1℃올리는 데 필요한 열의 양이다. 즉, 어떤 물질에 열을 가해 온도가 [math]\Delta T[/math]만큼 변했을 때의 열 [math]Q = C\Delta T[/math]가 된다. 비열(specific heat)은 단위 질량당 열용량이다. 비열이 낮을수록 열을 가해 물질의 온도 변화를 일으키기 쉽다. 어떤 물질의 비열이 [math]c[/math], 질량이 [math]m[/math]이며, 그 물질에 열을 가해 온도가 [math]\Delta T[/math]만큼 변했다면 비열이 일정하다는 가정하에 그 물질에 가해진 열 에너지의 양은 [math]Q = cm\Delta T[/math]이다. 이때 [math]\Delta T[/math]가 양수이면(물질의 온도가 올라가면) [math]Q[/math] 또한 양수이므로 외부에서 물질로 에너지가 들어온 것이며, 반대로 [math]\Delta T[/math]가 음수이면(물질의 온도가 내려가면), 물질에서 외부로 에너지가 빠져나간다. 만약 온도가 변함에 따라 물질의 비열 또한 변한다면 열의 양은 [math]Q = m\displaystyle\int_{T_i}^{T_f} c\, dT[/math]로 구할 수 있다([math]T_i, T_f[/math]는 각각 처음 온도와 나중 온도).
일상적인 환경에서 비열이 가장 큰 것은 다름아닌 물이다. 물의 비열은 4,186J/kg·℃로 지구상의 웬만한 물질보다 매우 높다. 물의 큰 비열로 인해 지구상의 대부분의 기상 현상이 발생하며, 큰 비열에서 비롯된 항상성은 생명체가 지구에서 살 수 있는 이유들 중 하나가 되었다.
2 열의 단위
열의 단위로는 cal, J, Btu(British thermal unit) 등이 쓰인다. 초창기 열에 대한 연구는 열소(熱素, caloric)라는 온도의 변화를 유발한다고 여겨진 유체의 기본 입자에 대해 이루어졌으며, 그것에서 열의 단위인 cal의 이름이 생겨났다. 1 cal(15도 칼로리의 경우)는 1 g의 물을 14.5℃에서 15.5℃로 올리는 데 필요한 에너지 전달량이다.[2] 사실 칼로리의 정의는 15도 칼로리 외에도 4도 칼로리 등 여러 가지가 있다. 자세한 것은 칼로리 참고. Btu는 영국 공학 단위계에서의 열량 단위로, 1 Btu(= 252 cal = 1054 J)는 1 lb의 물을 63℉에서 64℉로 올리는데 필요한 열이다. J은 원래 역학적 과정에서 정의된 단위이지만, 에너지의 단위인 만큼 에너지 전달량인 열의 단위로도 쓰이게 되며, 물리학에서는 대부분 J을 열의 단위로 사용한다. 역학적 과정에서의 일이 어떻게 열로 변하는지는 아래를 보자.
3 열의 일당량
역학적 계에서 비보존력이 작용하면 역학적 에너지는 보존되지 않으며, 역학적 에너지의 손실은 내부 에너지로 전환된다. 예를 들어 망치로 못을 두들기면 못이 뜨거워지는데, 이는 망치의 운동 에너지가 일을 통해 못에 전달되어 못의 내부 에너지로 변한 것이다. 이것을 위에 나온 식으로 표현하자면 [math]\Delta E_{int} = W + T_{MW}[/math]이다. 이때 [math]W[/math]는 망치가 못에 한 일이며, [math]T_{MW}[/math]는 못을 두드리며 나는 소리(역학적 파동)로 전달되는 에너지량이다. 즉, 역학적 에너지가 내부 에너지와 밀접한 관련이 있음을 경험적으로 확인할 수 있다.
영국의 물리학자 제임스 줄은 역학적 에너지의 변화량과 내부 에너지의 변화량 동등성을 처음으로 정립하였으며, 이를 실험으로 확인할 수 있도록 다음 그림에 나온 실험 장치를 고안하였다.

그림에서 도르래에 달린 두 개의 추가 높이 [math]h[/math]만큼 낙하하며 감소한 역학적 에너지는 [math]2mgh[/math](m은 추의 질량)[3] 이며, 역학적 에너지의 감소량이 물의 온도 증가에 비례함이 밝혀졌다. 따라서 위에서 나온 열의 단위인 cal와 역학적 과정에서의 단위인 J은 정비례 관계에 있으며, 훗날 정밀한 실험을 통해 1g의 물의 온도를 14.5℃에서 15.5℃로 올릴 때, 1 cal = 4.186 J [4]임이 밝혀졌다. 이 값을 열의 일당량(The Mechanical Equivalent of Heat)이라고 한다.

이렇게 생긴 열의 일당량 측정 기구도 있다. 무거운 추를 줄에 묶어 원통에 충분히 감은 뒤 원통을 돌리면 원통과 줄의 마찰에 의해 원통의 온도가 올라가고, 올라간 온도와 원통을 돌린 횟수를 통해 열의 일당량을 구할 수 있다.
4 잠열
물을 끓이는 경우, 물의 온도가 섭씨 100도일 경우 더 이상 물의 온도가 오르지 않고 끓기만 한다는 것을 알고 있다. 이처럼 공급된 에너지가 물질의 온도 변화에 영향을 미치지 않고 물질의 상전이에만 쓰이는 경우가 있다.
잠열 또는 숨은열은 다음과 같이 정의된다.
[math]L \equiv {Q\over \Delta m}[/math]
여기서 [math]\Delta m = m_{f}-m_{i}[/math]로, 높은 상 물질(예를 들어 얼음과 물의 경우 물이 높은 상 물질)의 나중 질량에서 처음 질량을 뺀 값이다. 잠'열'이지만 열과는 차원이 다른 변수라는 것을 알아두자.
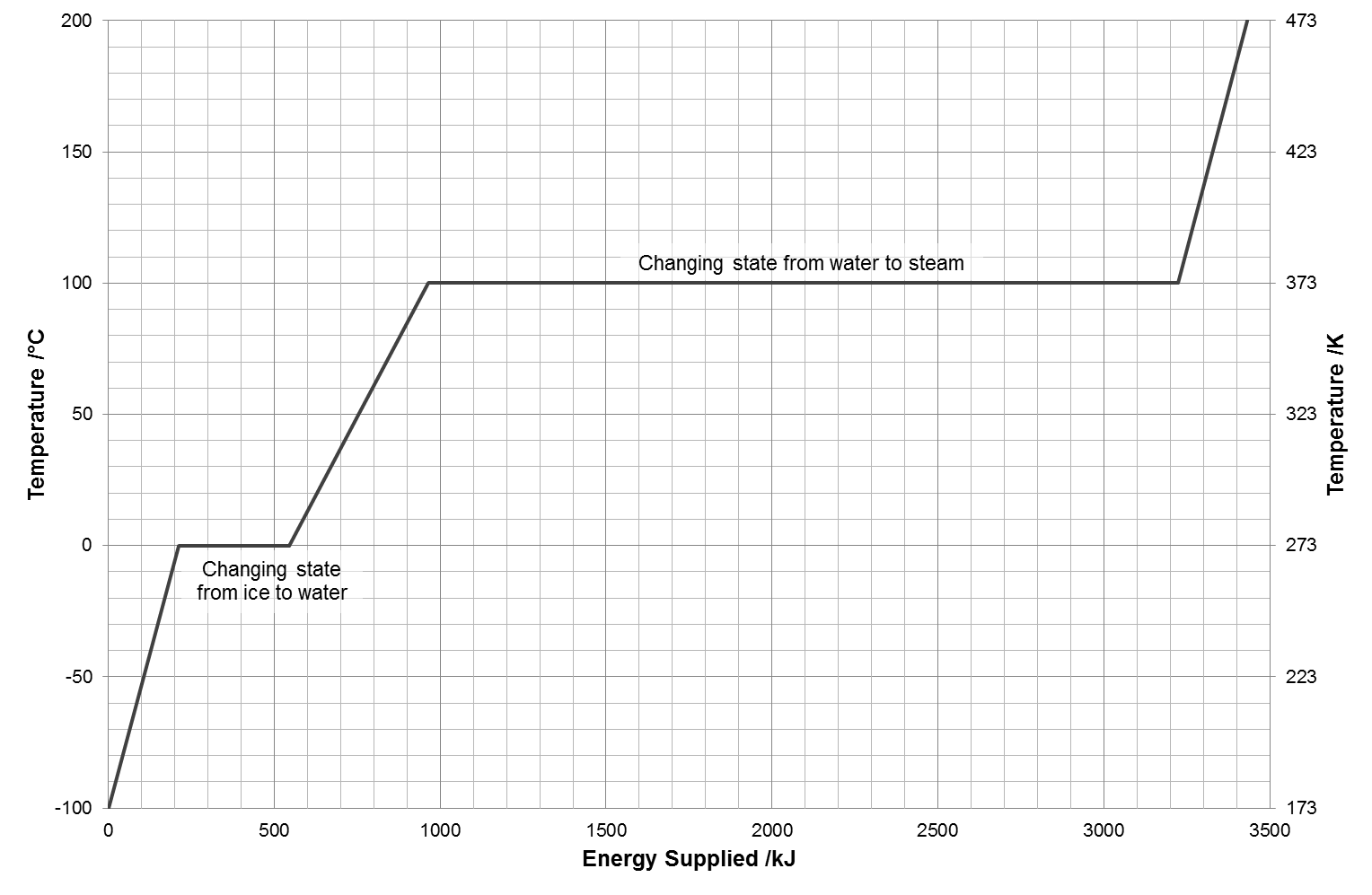
위의 도표에서 물의 온도가 0℃인 곳과 100℃인 곳에서 에너지가 계속 공급됨에도 불구하고 온도 변화가 없는 평평한 구간이 물의 상전이가 일어나는 구간이다. 공급된 에너지가 물의 상전이에만 쓰이는 것이다.
융해열 [math]L_f[/math]는 고체에서 액체로 상태 변화 시의 잠열을, 기화열 [math]L_v[/math]는 액체에서 기체로 상태 변화 시의 잠열을 나타낸다.[5] 만일 계에 에너지가 공급되어 물질이 낮은 상 물질에서 높은 상 물질로 변화 시 [math]\Delta m \gt0[/math]이므로 [math]Q \gt 0[/math]이다. 반대로 높은 상 물질에서 낮은 상 물질로 변화하며 [math]\Delta m \lt 0[/math]이므로 [math]Q \lt 0[/math]이다. 즉 에너지가 계에서 빠져나가는 것이다. 따라서 1.00KG의 -100℃의 얼음을 100℃의 수증기로 만들기 위해 필요한 열은 얼음의 온도를 올리는 데 필요한 열, 얼음을 물로 바꾸기 위한 열, 물의 온도를 올리는 데 필요한 열, 물을 수증기로 바꾸기 위한 열을 모두 더해서 구할 수 있다.
100℃의 수증기가 피부에 닿았을 때도 100℃ 물이 닿았을 때 못지 않게 위험한 이유가 바로 잠열 때문이다. 단위 부피당 내부 에너지는 물의 경우가 더 크겠지만 오히려 단위 질량 당 내부 에너지는 수증기가 훨씬 크다. 100℃의 수증기가 100℃의 물로 응축되며 열을 방출하고, 응축된 물의 온도가 내려가며 또 에너지를 방출하기 때문에 비록 단위 부피 당 에너지 밀도가 물에 비해 낮은 수증기일지라도 화상을 입기에는 충분하다.- ↑ 하지만 평형 상태에 도달하였다고 해서 에너지 이동이 더 이상 없는 것은 아니다. 쇳덩이에서 물로의 에너지 이동량과 물에서 쇳동이로의 에너지 이동량이 단지 같아져서 실질 에너지 변화량이 0인 것에 불과하다. 이를 동적 평형이라고 한다. 온도 차이가 나는 경우에도 온도가 낮은 쪽에서 높은 쪽으로 에너지 이동이 일어나긴 한다. 다만 높은 쪽에서 낮은 쪽으로의 에너지 이동이 훨씬 많아서 상쇄되는 것 뿐이다.
- ↑ 원래는 1 g의 물을 1℃ 올리는 데 필요한 에너지 전달량이었으나, 물의 비열이 온도에 따라서 달라지는 것이 밝혀져 정의가 바뀌게 되었다.
- ↑ 역학적 에너지는 운동 에너지와 포텐셜 에너지의 합이지만 추가 아주 천천히 내려온다면 운동 에너지가 0이 되어 포텐셜 에너지만 고려할 수 있다.
- ↑ 15도 칼로리의 경우
- ↑ 액체에서 고체로 변할 때의 응고열, 기체가 액체로 변할 때의 액화열은 각각 융해열과 기화열과 같은 값이다.