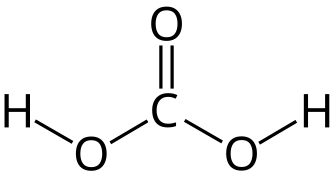
炭酸, carbonic acid.
1 개요
탄산은 이산화탄소가 수화된 산이다. 카보닐산이라고도 한다. 화학식은 H2CO3 또는 O=C(OH)2.[1] 흔히 볼 수 있는 것은 이산화탄소가 물에 녹았을 때다. 이산화탄소가 물에 녹으면 약간의 탄산이 발생하기 때문이다. 이산화탄소를 탄산가스라고도 하는 것은 여기에서 유래된 것이다. 이산화탄소가 녹은 물은 탄산수라 한다. 탄산수에서는 탄산과 이산화탄소가 평형을 이루게 된다.
| CO2 + H2O <-> H2CO3 |
이 때, 대부분의 이산화탄소는 탄산으로 변하지 않고 그냥 물에 녹아 있고, 소량만이 탄산으로 전환된다. 게다가 촉매 없이는 전환되는 속도도 느려서 실제로 위와 같은 평형상태가 되려면 오랜 시간이 필요하다. 이래 저래 뭔가 시원찮은 반응이다.맥주의 경우 발효 과정에서 탄산이 만들어진다. 거꾸로, 화학반응의 결과물이 일단 탄산이라면(예를 들면 포름산을 산화), 그 탄산은 대부분 위의 반응을 거쳐 물과 이산화탄소로 분해된다. 탄산의 불안정성은 탄소 원자 하나에 -OH 기가 두 개 붙어 있는 물질(같은자리 다이올)의 일반적인 특징이다. 탄산이 다이올은 아니지만.
탄산은 약산으로서 탄산염과 중탄산염의 2가지의 염을 생성한다. 탄산이 많은 상태에서 염기를 넣으면 중탄산염이 생성되고, 염기가 많은 상태에서 탄산을 넣으면 탄산염이 생성된다.
탄산 이온은 CO32-인데, 이로 인해 삼산화탄소 드립이 있는데 실제로 그런 물질이 있다. 영어 위키백과 이산화탄소와 산소원자가 반응하면 생기는 매우 불안정한 물질이라고 한다.
2 신체에서
신체의 혈액은 pH 값이 잘 변하지 않아서 웬만큼의 산이나 염기가 추가되어도 pH 7.4 에서 +-0.05 정도만 변할 뿐이다. 이런 용액을 완충용액(a buffer solution)이라 하는데, 혈액이 완충용액이 되는 이유는 탄산과 그 염인 중탄산염이 녹아 있기 때문이다.
NaOH와 같은 센 염기가 첨가되어 수산화 이온(OH-)이 생기면
| H2CO3(aq) + OH-(aq) → HCO3-(aq) + H2O(l) |
처럼 탄산(H2CO3)이 출동해서 염기를 줄이고
HCl과 같은 센 산이 첨가되어 H+ 이온으로 인해 옥소늄 이온(H3O+)가 생기면
| HCO3-(aq) + H3O+(aq) → H2CO3(aq) + H2O(l) |
처럼 중탄산염(HCO3-) 덕택에 산성이 줄어든다.
이러한 중탄산염과 탄산은 호흡을 통해 이산화탄소를 제거하는 과정에서 생성된다. 원래 이산화탄소의 수화작용(水化作用)은 촉매 없이는 매우 느리다. 그러나 적혈구에는 탄산 탈수 효소가 있어서, 신체 조직의 이산화탄소가 빠르게 탄산으로 변할 수 있다. 아울러 그 효소는 만들어진 탄산으로부터 수소 이온 하나씩을 분리시켜 중탄산염이 혈액에 녹아 있는 형태로 변환하는 역할도 한다.
| H2CO3 -> H+ + HCO3-(중탄산염) |
폐에서는 이 과정이 반대로 돼서 중탄산염이 다시 CO2로 바뀌어 날숨에 섞여서 배출된다. 이 과정에서의 탄산과 중탄산염이 완충용액까지 제공해주니 꿩 먹고 알 먹고.
3 탄산음료에서
콜라, 사이다 등 탄산음료의 제조공정을 보면 대기압의 수 배에 달하는 압력을 가하고 온도를 서서히 낮추는 방법으로 이산화탄소를 녹이는데, 이 녹은 이산화탄소의 단지 일부만 탄산으로 전환된다. 그리고 시원한 느낌을 주는 것은 탄산이 아니라 녹아 있는 이산화탄소이기 때문에 탄산을 만들어 녹이는 것은 아니다. 간단히 말해 탄산은 그냥 산의 일종이다.