Boiling Point / 비등점(沸騰點)
1 개요
다른 말로는 비등점. 끓는점은 물체의 증기 압력이 외부 압력과 같아지는 온도로, 액체가 기화되는 온도이다.
액체는 끓는점 이하의 온도에서도 기화할 수 있는데, 이를 증발이라고 한다. 증발은 오로지 액체의 표면에서만 일어나는데 비해 끓음은 모든 액체에서 일어난다.[1]
토마스 쿤의 이론을 반박하는데 사용되었다. 끓는점이 처음 정의될 때 끓는점은 끓는 물 표면에 있는 증기의 온도로 정의되었는데, 끓음 현상에 대한 이론은 그 후에도 수시로 바뀌었으나 이 정의와 그 수치는 변하지 않았고 오히려 논의의 중심이 되었다. 장하석은 이를 통해서 이와같은 중간 단계의 물리 법칙은 패러다임의 변화에도 별 영향을 받지 않는다고 하였다.[2]
2 끓는점과 압력
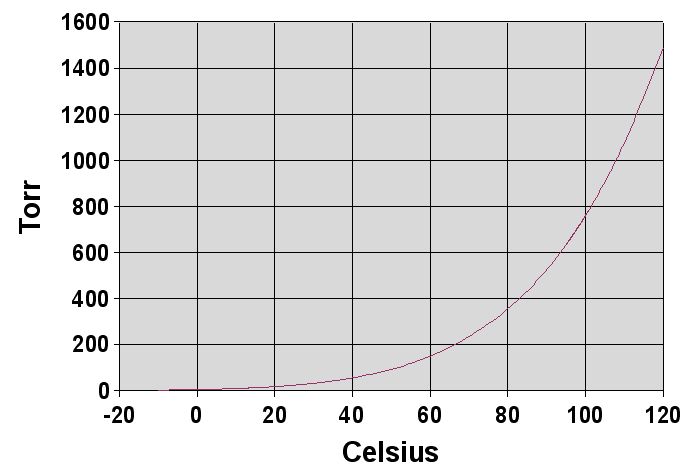
끓는점은 외부 압력에 관계되는 값이기에, 둘은 떼어둘 수 없는 관계이다. 정의에서 보듯이 끓는점은 증기 압력이 외부 압력과 같아지는 온도로, 외부 압력이 다르다면 끓는점은 달라질 수 있다. 실제로 1기압에서 물의 끓는점은 100℃이지만, 100기압에서는 300℃가량이다. 반대로 0.1기압에서는 50℃가량이다. 이는 증기압력이 온도에 비례해서 커지기 때문이다.
따라서 끓는점을 표시할 때는 외부 압력 또한 같이 표시해야 하나, 보통 사람들이 사는 공간은 거의 1기압이기 때문에 대부분은 1기압에서의 끓는점만을 표시한다. 이때 1기압은 지구 해수면에서의 압력, 101.325 kPa이다.
다만 끓는점이 압력에 따라 무한히 증가하지는 않는다. 압력이 너무 강해지다보면 액체와 기체와의 차이가 거의 사라지기 시작하는데, 임계점(critical point)을 넘어서면 액체와 기체의 중간 상태인 초임계유체가 된다. 액체와 기체 사이의 경계가 없다보니 그 사이를 정의하는 끓는점이라는 의미가 사라지게 되는 것.
3 끓는점과 순물질
물론 압력에 영향을 받긴 하지만 물질마다 끓는점이 다르므로 물리적 특성으로 사용할 수 있다. 특히 온도와 압력만 조절하면 되는 특성 때문에 여러 물질이 혼합된 경우 그것들을 분리하는데 상당히 많이 쓰인다. 가장 대표적인 예시는 분별증류. 끓는점의 차이를 통해 여러 물질을 분리하는 방법으로 이 방법이 없으면 액체 산소는 커녕 자동차도 굴리지 못했고, 증류주같은 것도 없었을 것이다.