| 국문 | 배위 결합 |
| 한문 | 配位結合 |
| 영문 | Coordinate covalent bond, Dative bond |
목차
1 개요
화학 결합의 하나로, 공유 결합의 일종이다. 공유 결합은 상호 간의 전자공유가 일어나지만, 배위 결합의 경우 한 쪽 원자에서 전자쌍을 일방적으로 제공하는 형태로 결합을 형성한다. 다시 말하자면, 비공유 전자쌍을 지닌 배위자(루이스 염기)가 전자가 부족한 양이온(루이스 산)에게 전자쌍을 주면서 형성되는 결합.
일반적으로, 공유 결합이 비금속 간의 결합을, 금속 결합이 한 금속 양이온 간의 결합을 일컫는다면 배위 결합의 경우 금속 양이온을 중심으로 하고 배위자가 둘러싸는 착화합물을 설명하는데 사용된다.[1]
2 예시
삼플루오린화붕소와 암모니아의 결합이 대표적인 예시이다.
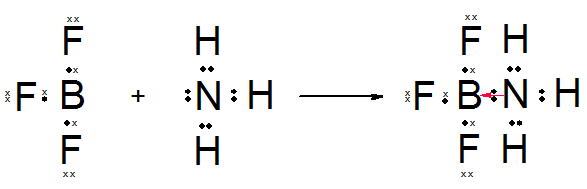
BF3[2] + NH3 = F3BNH3
3 착화합물(Complex Compound)
- 착화합물은 배위화합물(coordination compound)의 한 종류로, 착이온과 상대이온으로 구성된다. 착이온은 금속 양이온에 리간드가 결합한 것이고, 상대이온은 배위화합물의 알짜전하를 0으로 만들기 위해 필요한 이온이다. 예를 들어 [Ni([math]NH_4[/math][math])_4[/math]][math]Cl_2[/math]에서 대괄호 안이 착이온, 대괄호 밖 두 개의 [math]Cl^-[/math]이 상대이온.
착화합물에서 특히 중심 금속 양이온이 전형 금속보다는 전이 금속인 경우에 더 관심의 대상이 되는데, 이는 전이 금속 이온을 중심 금속으로 하는 착화합물이 흔히 자기성이 가지고 있을 뿐만 아니라 특정 파장의 가시광선을 흡수하여 각각 독특한 색깔을 나타내며 산업적, 생물학적 역할도 하는 등 중요한 특징을 지니기 때문이다. 예를 들어 헤모글로빈은 철 이온([math]Fe^{2+}[/math] 또는 [math]Fe^{3+}[/math])에 포르피린이라는 네 자리 리간드가 결합한 헴(heme) 착물을 포함한다.
3.1 리간드(Ligand)
- 중심 금속 이온에 전자쌍을 제공하여 배위 결합을 형성하는 물질로, 중성분자 또는 음이온이다. 배위자라고도 한다. 하나의 중심 금속 이온과 몇 개의 결합을 형성하느냐에 따라 리간드의 자리 수가 결정된다. 결합을 한 개 형성하면 한 자리(monodentate), 두 개면 두 자리(bidentate), 그 이상이면 여러 자리(polydentate) 리간드라 한다. 특히 두 자리 이상 리간드를 킬레이트(chelate)라 부른다.
- 리간드의 예시는 아래 표를 참조.
| 한 자리 | [math]H_2[/math]O, [math]CN^-[/math], [math]SCN^-[/math], [math]X^-[/math](halogen), [math]NH_3[/math], [math]OH^-[/math] |
| 두 자리 | en, [math]ox^{2-}[/math], bipy, o-phen, gly |
| 여러 자리 | dien, trien, [math]EDTA^{4-}[/math] |
3.2 배위수(Coordination Number)
- 착이온 내에서 금속 양이온과 리간드가 이루고 있는 배위 결합의 수를 말한다. 예를 들어 [Rh([math]NH_3[/math][math])_4[/math](en)][math]Cl_3[/math]에서 배위수는 6, Pt([math]NH_3[/math][math])_2[/math][math]Br_2[/math]에서 배위수는 4이다.
- 배위수는 금속 이온의 크기, 전하, 전자 배치에 따라 두 개에서 여덟 개까지 다양한데, 6배위가 가장 흔하고 그 다음이 4배위, 2배위 순이다. 6배위 착물은 팔면체 구조, 4배위 착물은 사면체나 사각평면 구조, 2배위 착물은 선형 구조를 형성한다.
4 이성질현상(Isomerism)
- 배위 화합물의 이성질현상에는 구조 이성질현상(structural isomerism)으로 배위 이성질현상(coordination isomerism)과 결합 이성질현상(linkage isomerism)이 있고, 입체 이성질현상(stereoisomerism)으로 기하 이성질현상(geometrical isomerism)과 광학 이성질현상(opitcal isomerism)이 있다.
4.1 배위 이성질현상
- 배위 이성질현상은 구조 이성질현상에서 착이온의 조성이 달라져 생긴다. 예를 들어 [Cr([math]NH_3[/math][math])_5[/math][math]SO_4[/math]]Br과 [Cr([math]NH_3[/math][math])_5[/math]Br][math]SO_4[/math]는 서로 배위 이성질체 관계이다.
4.2 결합 이성질현상
- 구조 이성질현상 중 착이온의 조성은 같으나 중심 금속 이온에 결합하는 원자가 다른 것이다. [Co([math]NH_3[/math][math])_4[/math]([math]NO_2[/math])Cl]Cl 과 [Co([math]NH_3[/math][math])_4[/math](ONO)Cl]Cl를 예로 들면, 첫 번째 화합물에서 리간드([math]NO_2[/math]-, nitro)는 N을 통해 중심 금속 이온에 배위하는 한편 두 번째 화합물에서 리간드([math]ONO^-[/math], nitrito)는 O를 통해 중심 금속 이온에 결합한다. 참고로 리간드가 [math]SCN^-[/math]인 경우에도 S또는 N이 금속 이온에 결합할 수 있어 결합 이성질현상이 가능하다.
4.3 기하 이성질현상
- 시스-트랜스 이성질현상(cis-trans isomerism)이라고도 하는데, 리간드의 공간 배열이 달라져 생기는 이성질현상이다. 예를 들어 사각평면 구조인 [Pt([math]NH_3[/math][math])_2[/math][math]Cl_2[/math]]에서 암모니아 분자가 서로 이웃하거나(cis) 반대편에 가로질러(trans) 존재할 수 있다.
4.4 광학 이성질현상
- 간단히 말하자면 한 화합물의 거울상을 그렸을 때 원래 구조와 겹쳐지지 않는 현상이다. 이때 두 화합물은 서로 거울상 이성질체 관계이며 각 화합물은 카이랄성을 가진다. 예를 들어 [Co(en[math])_2[/math][math]Cl_2[/math][math]]^+[/math]의 트랜스 이성질체는 거울상과 겹쳐지므로 둘은 동일 화합물이고 광학 이성질현상을 나타내지 않는다. 반면 시스 이성질체는 거울상과 겹쳐지지 않으므로 서로 거울상 이성질체 관계이고, 광학 이성질현상을 나타낸다.
5 착이온의 결합과 구조, 물성
- 착이온의 결합과 구조는 원자가 결합 이론, 착이온의 자기성과 색깔은 결정장 모형으로 설명할 수 있다.
5.1 원자가 결합 이론(Valence Bond Theory)
- 금속 이온과 리간드는 Lewis 산-염기 반응을 통해 배위 공유 결합을 형성한다. 이때 리간드는 Lewis 염기로서, Lewis 산인 금속 이온의 비어있는 궤도함수에 고립된 전자쌍을 제공한다.
- 결과적으로 금속 이온은 팔면체 구조에서 [math]d^2[/math][math]sp^3[/math], 사면체 구조에서 [math]sp^3[/math], 평면사각형 구조에서 [math]dsp^2[/math], 선형 구조에서 sp 혼성오비탈을 형성한다.
5.2 결정장 이론(Crystal Field Theory)
- 결정장 이론은 금속과 리간드의 상호작용으로 인한 금속 이온의 d 오비탈 갈라짐에 초점을 둔다. 즉 리간드가 접근할 때 d 오비탈과의 배향에 따라 d 오비탈 간 에너지 차이가 생기는데, 이 에너지 차를 결정장 갈라짐 에너지(Δ, delta)[3]라 하고 이것으로 착이온의 물성을 설명한다.
5.2.1 착이온의 자기성
- 팔면체 착물을 예로 들어 설명하자면, 리간드가 x,y,z축에서 각각 접근할 때 리간드와 정면으로 반발하는 d [math]x^2[/math]-[math]y^2[/math]와 d [math]z^2[/math] 오비탈([math]e_g[/math])은 상대적으로 에너지가 높아지는 반면, 리간드 사이사이에 위치한 [math]d_{xy}[/math], [math]d_{xz}[/math], [math]d_{yz}[/math] 오비탈([math]t_{2g}[/math])은 상대적으로 에너지가 낮아지게 된다. 이때 [math]t_{2g}[/math]와 [math]e_g[/math]의 에너지 차가 팔면체 착물의 결정장 갈라짐 에너지(△o)이다.
- 이제 이 d 오비탈들에 전자를 채워야 하는데, 에너지가 낮은 [math]t_{2g}[/math]에 먼저 홀전자를 모두 채운 뒤 다음 전자를 채우기 위해서는 에너지가 필요하다. 센 장(strong field)에서 [4] 전자는 △o를 극복하지 못하고 [math]t_{2g}[/math]에 채워지는데, 이처럼 홀전자 수가 최소가 되도록 전자가 채워지는 것을 저스핀(low spin)이라 한다. 반대로 약한 장(weak field)[5]에서는 전자가 고스핀(high spin)으로 [math]t_{2g}[/math]보다 [math]t_{2g}[/math]에 채워지는 것이 더 안정하다.
위의 설명을 바탕으로 착이온의 자기성을 설명할 수 있다. 팔면체 착물을 형성하는 [math]Co^{3+}[/math][6]의 d 오비탈에 저스핀 또는 고스핀으로 전자를 채워보자. 저스핀으로 채우면 홀전자가 없으므로 반자성을 띤다. 반면 고스핀으로 채우면 4개의 홀전자가 있으므로 상자성을 나타낸다.
- 결정장 갈라짐 에너지의 크기에 영향을 미치는 요인으로는 리간드, 금속 이온의 전하량, 금속의 종류, 그리고 입체 구조가 있다.
1. 리간드의 분광화학적 계열은 다음과 같다.
- [math]I^-[/math] < [math]Br^-[/math] < [math]Cl^-[/math] < [math]F^-[/math] < [math]OH^-[/math] < [math]H_2[/math]O < [math]SCN^-[/math] < [math]NH_3[/math] < en < [math]NO_2[/math]- < [math]CN^-[/math] < CO
오른쪽에 있을수록 강한장 리간드인데, 강한장 리간드일수록 △값이 크고 최대 흡수 파장(λ)이 짧다.
2. 금속 이온의 전하량이 클수록, 즉 산화수가 클수록 리간드가 금속 이온에 더 가까이 끌려가므로 리간드가 d 오비탈과 더 강하게 반발한다. 따라서 금속 이온의 전하량이 클수록 △값이 크다.
3. 같은 족 금속에서, 그 크기가 클수록 d 오비탈과 리간드의 겹침이 커져 △값이 증가한다.
4. 사면체(△t) < 팔면체(△o) < 사각평면(△sp) 순으로 △값이 크다.
- 사면체의 경우 리간드와 정면으로 충돌하는 d 오비탈이 없어 △값이 팔면체의 약 4/9 정도 크기로 매우 작다. 따라서 항상 약한 장(고스핀)이 된다.
- 사각평면의 리간드 배열은 팔면체에서 z축 상의 리간드를 제거한 것으로 생각할 수 있다. 이때 d [math]z^2[/math]의 에너지는 크게 낮아지고 d [math]x^2[/math]-[math]y^2[/math]의 에너지는 가장 높아진다.