- 상위 항목 : 생물학 관련 정보
목차
1 개요
전사(transcription)는 DNA로부터 RNA를 만들어내는 과정을 의미한다. 이 때 전사되는 RNA들에는 mRNA, tRNA, rRNA, ncRNA, 리보자임 등이 있다.
2 전사의 단계
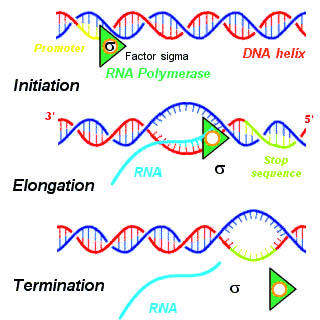
전사는 개시(initiation), 신장(elongation), 종결(termination)의 3가지 단계로 이루어져 있다. 간략하게 소개하자면, 개시 과정에서는 RNA 중합효소(RNA polymerase)가 DNA의 프로모터 부위에 결합해 이중결합을 풀고 합성을 시작한다. 신장 과정은 RNA를 뽑아내면서 교정(proofreading)과 동시에 중합효소 앞의 DNA 이중결합을 풀고, 뒤쪽에 풀려있는 DNA는 다시 잠근다. 종결과정은 말그대로 만들어진 RNA와 RNA 중합효소가 떨어져나가는, 전사가 끝나는 단계다.
전사는 원핵생물과 진핵생물에서 약간의 차이가 있다. 원핵생물은 RNA 중합효소를 한 종류만 쓰고, 스스로 개시를 할 수 있다. 또한 짧은 길이의 non-coding DNA[1]에 의해 조절된다. 진핵생물은 RNA 중합효소가 세 종류나 되고, GTF(general transcription factor)라는 전사인자가 있어야만 전사가 개시된다. 또한 긴 길이의 조절 서열에 의해 원핵생물보다 정교하게 조절된다.
2.1 DNA 복제와의 차이
복제는 DNA로부터 DNA를 만들지만, 전사는 DNA로부터 RNA를 만드는 과정이다. 그리고 복제의 경우는 primer가 필요하지만, 전사는 primer가 필요없다. 또한 전사는 교정 기전(proofreading)이 부족하기 때문에 복제보다 덜 정확하다. 복제에 대해서는 복제(생물학) 참조
3 원핵생물의 전사
3.1 개시
프로모터는 중합효소가 붙어 전사가 개시되는 염기서열으로, 유전자 앞에 있다.[2] 유전자마다 프로모터의 서열이 다르지만, 중합효소가 결합하는 서열은 잘 보존되어 있다.[3] 전사가 시작되는 지점을 +1으로 두고 오른쪽(뒤 쪽)으로 갈 수록 숫자가 증가(+)한다고 할 때, 보존 서열은 -10자리와 -35자리를 중심으로 위치한다.[4]
600px
사실 원핵생물마다 프로모터가 약간 다른데, 어떤 프로모터는 'extended -10'이라고 하여 -35자리가 없는 대신 -10자리가 연장되어 있다.[5] 또 어떤 프로모터는 -10 자리 근처에 'discriminator'라는 서열을 가져, DNA와 RNA 중합효소 간의 안정성에 영향을 준다. 마지막으로 어떤 프로모터는 'UP-element[6]'라는 서열이 - 35자리 보다 앞쪽에 존재한다. UP-element는 rRNA[7] 발현 유전자에서 자주 보이는데, RNA 중합효소를 이루는 α 서브유닛의 카르복실 말단(αCTD)이 이 부위를 인식해 전사 개시를 돕는다.
사실 RNA 중합효소는 DNA 어느 지점에서든 전사를 할 수 있으나, '시그마 인자(σ factor)'의 결합으로 전효소(holoenzyme)가 되어 프로모터에서만 전사를 개시할 수 있게 된다. 시그마 인자는 1.1 부터 4.2까지의 부위로 나뉘는데, 4.1~4.2 부위는 -35자리를, 2.1~2.4번부위는 -10자리를 인식하며 2.3부위는 특히 DNA 이중결합을 분리하는 데 가담한다.[8]
3.2 신장
RNA 중합효소가 프로모터에 결합한 후(개시), 전사를 신장하기 위해서는 RNA 중합효소가 프로모터를 벗어나야 한다. RNA 중합효소는 프로모터를 벗어날 때까지 프로모터에서 염기 10개 미만 길이의 서열을 RNA를 합성했다가, 버렸다가를 반복한다. 원핵생물의 개시과정에서 중합효소의 활성부위가 어떻게 이동하는지는 아직 밝혀지지 않았는데, 세 가지 가설이 제시되었다.[9]
첫째는 일시적 여행(Transient excursion) 가설[10]로, 단순히 RNA 중합효소가 앞뒤로 이동한다는 가설이다. 두번째는 자벌레(inchworming) 가설로, RNA 중합효소의 한쪽은 -35자리에 고정되어 있고, 다른 한쪽은 스프링을 당기듯이 늘어나서 이동한다는 가설이다. 마지막 가설은 짜부라뜨리기(Scrunching)(..)로, RNA 중합효소 자체는 가만히 있는데 DNA를 끌어당겨서 신장을 시작한다는 가설이다. 학계에서는 마지막 가설이 가장 지지받는다. 첫번째 가설은 시그마 인자의 존재 가치가 희미해지며[11], 두번째 가설은 에너지가 많이 소모되기 때문이다. 시그마 인자는 개시 단계가 끝나면서 떨어져 나간다.
신장 과정은 RNA 중합효소 내부에서 진행된다. 중합효소의 활성부위에는 9개의 염기쌍이 결합한 RNA-DNA가 놓여있고, 이 상태를 이동하지 않은(Untranslocated) 중합효소라고 부르며 0 상태이다. 중합효소는 곧 +1 상태(forward translocated)가 되면서 염기 하나 만큼 이동한다. 즉 총 8개의 염기쌍이 결합한 상태가 되고, DNA가 열려 하나의 결합되지 않은 염기가 생긴다. 이 상태에서 염기가 하나 합성되여 다시 0 상태가 된다. 이 과정이 반복되면서 RNA가 신장된다. 가끔 교정과정을 위해 -1 상태(reversed translocated)가 되어 오류난 부분을 가수분해 하기도 한다.
3.3 종결
원핵생물의 전사 종결은 두가지로 구분된다. 하나는 Rho-의존적(dependent) 종결이고, 다른 하나는 Rho-독립적 종결이다. 우선 종결은 RNA 중합효소가 떨어져 나가는 단계라는 것을 다시 상기하자.
Rho-의존적 종결은 종결에 Rho라는 단백질이 필요하다. Rho는 6개의 분자가 중합하여 생기는 헥사머(hexamer)인데, ATP를 가수분해해서 생기는 에너지로 전사를 종결시킨다. 이 에너지가 어떻게 종결 시키는지에 대해서는 2가지 모델이 있다. 하나는 에너지가 중합효소의 형태를 변형시켜, 더 이상 DNA와 결합할 수 없게 한다는 것이다. 다른 하나는 TRCF같은 단백질이 전사가 종결되야 하는 지점 근처에 결합해 있다는 가설이다. 즉 에너지가 중합효소를 앞으로 이동시키면, TRCF와 충돌하게 되고, 그 충돌의 영향으로 중합효소가 분리된다는 이야기.
Rho-독립적 종결은, RNA 자체에 의한 종결 유도를 말한다. Rho-독립적 종결을 하는 유전자 뒤에는 특별한 역반복(inverted repeat) 서열과 8여개의 A 염기들이 있다. 역반복 서열이란 어떤 서열에 상보적인 서열이 같은 DNA 가닥에 담겨 있는 것을 말한다. ···AGA····TCT··· 같은 서열을 생각해보면 된다. 이 역반복 서열은 DNA에서는 상보적인 가닥과 이중가닥을 이루기 때문에 얌전(..)하지만, RNA로 전사되면 사정이 달라진다. RNA는 한 가닥이지만 스스로 접혀서 3차원 구조를 이룬다. 즉 역반복 서열은 RNA로 전사되면서 헤어핀(hairpin) 구조를 형성해 신장을 방해한다.[12] 헤어핀 구조는 위의 TRCF 가설과 같이 충돌로 중합효소를 분리시킨다. 그렇다면 8여개의 A 염기들은 어떤 역할을 할까? 이 녀석들은 전사되면서 RNA와 A:U 염기쌍을 이룬다. 그런데 A와 U는 염기쌍들의 조합(A:T,C:G 등) 중 가장 약한 결합이다. 따라서 중합효소에서 RNA가 쉽게 떨어져 나올 수 있게 해준다.
4 진핵생물의 전사
4.1 특징과 진핵생물의 프로모터
진핵생물은 원핵생물과 달리, 3개의 RNA 중합효소가 작용한다. 또한 GTFs(general transcription factors)라는 개시인자들이 필요하다. (원핵생물은 시그마 인자만 필요로 한다.) 또한 진핵생물의(in vivo) DNA는 뉴클레오솜이나 염색질 상태로 존재하는데, 전사를 하기 위해서는 해당 구조들을 풀어야 한다. 따라서 매개 복합체(mediator complex), DNA 결합 단백질, 염색질 구조변경 단백질(chromatin modifying enzyme) 등 또한 필요로 한다.
진핵생물은 RNA 중합효소 Ⅰ,Ⅱ, Ⅲ를 가지고 있고, 이들의 역할은 다음과 같다.
| Pol Ⅰ | rRNA 전사 |
| Pol Ⅱ | 일부 miRNA와 모든 mRNA 전사 |
| Pol Ⅲ | tRNA와 일부 sRNA 전사 |
이 아래부터는 가장 보편적인 중합효소인 PolⅡ를 통한 전사를 설명한다.

진핵생물의 프로모터에는 '핵심 프로모터(core promoter)' 라는 것이 있다. 핵심 프로모터는 앞에 서술한 GTF들이 결합하는 자리로, 즉 전사 개시에 요구되는 최소한의 염기서열이라고 보면 된다. 예를 들어 BRE에는 TFⅡB(GTF)가 결합하고, Inr에는 TFⅡD(역시 GTF)가 결합한다던가 하는 식이다. TATA박스 또한 TFⅡD가 결합하는 자리다. 물론 이런 핵심 프로모터들이 모두 프로모터에 들어있는 건 아니다. 어떤 유전자의 프로모터에는 TATA가 없기도 하고 어떤 유전자에는 있고 그렇다. 그리고 TFⅡD가 인식 하는 서열은 Inr, TATA 뿐만 아니라 DCE, DPE도 있다. TATA 박스는 주로 DCE와 함께 나타나며, DPE와 TATA 박스는 같이 나타나지 않는다. 저 그림은 엄밀히 따지자면 잘못된 것이다.
진핵생물의 프로모터에는 또 조절 서열(regulatory sequence)가 있다. 말 그대로 전사를 조절하는 서열들로 증폭자(enhancer), 억제자(repressor) 등의 조절 단백질들이 결합하는 자리다. 주로 핵심 프로모터들의 상류에 위치한다. (상류란 DNA 앞부분을 의미한다.)
4.2 개시
GTF들은 원핵생물의 시그마 인자 같은 역할을 수행한다. 즉 중합효소가 프로모터와 결합하는 것을 돕고, 이중나선의 분리를 수행하며, 신장 단계로 넘어가는 것을 돕는다. GTF들은 서로 모여서 RNA 중합효소와 함께 개시전 복합체(preinitiation complex)를 형성한다. 개시전 복합체는 주로 TATA 박스에 결합하므로, TATA박스를 지닌 프로모터 기준으로 알아보자.
PolⅡ와 상호작용하는 GTF에는 TFⅡ(이름은 Transcription Factor + Pol Ⅱ에서 유래), TBP(TATA-binding protein), TAF(TBP-associated factor) 등이 있다. TFⅡ 중에서 TFⅡD와 TBF는 TATA 박스를 인식해서 결합하고, TAF는 TBP와 TATA 박스의 결합을 돕는다.
이제 본격적으로 전사 개시 과정을 알아보자.

1) TFⅡD와 TBP가 TATA 박스를 인식해 결합한다.
-> TBP의 베타 병풍(beta sheet)이 DNA의 좁은 홈(minor groove)를 인식하는데, 이 때 DNA가 약 80 도 정도로 구부러지면서 좁은 홈은 넓어진다.
| 300px |
| 이렇게 구부러진다. |
2) TFⅡA와 TFⅡB가 주변에 결합한다.
->TFⅡA는 TBP-TATA박스 결합을 안정화하고, TBP에 의헤 꺾인 DNA의 구조를 유지한다.
->TFⅡB는 DNA의 넓은 홈(major groove)에 결합하는데, 비대칭적으로 결합하기 때문에 전사가 한쪽 방향으로만 진행되도록 한다. 또한 TBP-TATA 복합체와 PolⅡ 사이의 다리역할을 한다.
| 300px |
| 이런식으로. 그림엔 안 나타나있지만, TBP 왼쪽에 TFⅡA가 결합해있다. |
3) TFⅡF가 PolⅡ와 결합한 채로 결합한다.
->TFⅡF는 TBP-TFⅡB-PolⅡ의 결합을 안정화한다.
4) TFⅡE와 TFⅡH가 결합한다.
->TFⅡE는 TFⅡH를 recruit하고 조절한다.
5) TFⅡH는 DNA 이중나선을 분리한다
->TFⅡH는 헬리카아제, ATPase 활성을 가지기 때문이다. TFⅡH는 또 키나아제 활성을 가지고 있기 떄문에 Pol의 CTD를 인산화시킨다. 이는 전사로 만들어지는 mRNA를 가공하기 위한 마커(marker) 역할을 한다.
이제 DNA에 중합효소가 결합해 mRNA를 중합할 준비가 되었다. 신장 단계로 넘어가기 위해서는 원핵생물과 마찬가지로 프로모터에서 탈출할 필요가 있다. 프로모터 탈출에는 ATP 가수분해와 인산화라는 두 단계가 필요하다. 여기엔 TFⅡH의 역할이 중요하다. 위에 언급했듯이 TFⅡH는 ATPase와 키나아제 활성을 지니기 때문이다. TFⅡH가 PolⅡ의 카르복실 말단 영역 꼬리(CTD tail)을 인산화 시킴에 따라 중합효소가 GTP들과 프로모터에서 탈출한다. PolⅡ의 CTD 꼬리는 800Å정도의 길이고, Tyr-Ser-Pro-Thr-Ser-Pro-Ser(YSPTSPS)라는 6개의 아미노산 서열이 반복[13]되는데 이 중에서 Ser이 인산화 된다. CTD 꼬리의 5번 Ser이 인산화되면 프로모터를 탈출하는 것으로 보인다.
어떻게 딱 5번 Ser을 인산화시킬까? 아까 진핵생물의 전사에는 매개 복합체가 필요하다고 했다. 체내(in vivo)에서 DNA가 염색질로 존재하기 때문이다. 매개 복합체는 20개가 넘는 소단위체(subunit)들로 구성되어 있는데, 그만큼 기능 및 기질이 다양하다는 의미가 된다. 매개복합체의 한 쪽은 개시전복합체의 CTD tail에 결합하고, 다른 한 쪽은 증폭자나 억제자 같은 조절 단백질에 결합해 전사를 조절한다.(이 '다른 한 쪽'은 DNA를 구부려서, 전사하려는 유전자에서 아주 멀리 떨어진 조절 서열에 붙은 조절 단백질과도 결합이 가능하다.) 매개복합체는 TFⅡF와 함께 TFⅡH의 키나아제 활성을 조절하는 것으로 보인다.
4.3 신장
프로모터를 탈출한 이후 신장이 되기 위해서는 또 새로운지긋지긋한 단백질들이 요구된다. 하나는 신장 인자(Elongation factor), 나머지 하나는 RNA 가공 인자(RNA processing factor)다. 두 놈 모두 중합효소의 CTD tail를 인식하여 활동한다.
신장인자는 P-TEFb, SPT5, ELL, TFⅡS 등이 있으며, 이들의 대략적인 기능은 다음과 같다.
| 인자 | 기능 |
| P-TEFb | 키네이즈. CTD 꼬리 YSPTSPS의 2번 Ser를 인산화. 이 녀석에 의해 TAT-SF1이나 hSPT5가 활성화됨.[14] |
| SPT5 | TFⅡF나 Pol에 결합해, 개시 때 모인 전사인자들을 털어냄 |
| ELL 단백질 | 전사가 일시적으로 멈추는 것을 방지해 전사를 촉진. |
| TFⅡS | 전사 촉진과 함께, RNase 활성을 촉진해 잘못 전사된 서열을 교정 |
진핵생물의 DNA는 뉴클레오솜의 형태로 packing되어 있기 때문에, 전사 신장을 진행하면서 히스톤 단백질들을 마주치게 된다. 히스톤 단백질들은 전사에 매우 방해되기 때문에[15] 만날 때마다 제거할 필요가 있다. 이를 전문적으로 하는 대표적인 인자가 'FACT(FAcilitates Chromatin Transcription)'다. FACT는 SSRP1과 Spt16의 이합체(heterodimer)인데, 중합효소 앞의 뉴클레오솜은 분해하고, 중합효소가 지나간 후에는 다시 조립하는 역할을 한다.
먼저 뉴클레오솜을 구성하는 중심 히스톤(core histone)은 H2A, H2B, H3, H4가 있고, 뉴클레오솜은 H3-H4의 4합체(tetramer)과 H2A-H2B 이합체 2개로 이루어진 8합체(octamer)다. FACT의 SSRP1은 H3-H4 4합체와 상호작용하고, Spt16은 H2A-H2B 이합체와 상호작용해서 분해시켜서 최종적으로 뉴클레오솜 구조를 풀어놓는다. Spt6이라는 녀석도 있는데, H3에 결합해 뉴클레오솜의 재조립을 돕는다. 물론 이것은 여러 모델 중 하나일 뿐, FACT의 정확한 기전은 아직 밝혀지지 않았다.
4.3.1 RNA 가공
RNA 가공인자를 알아보기 전에 RNA 가공이 뭔지부터 알아보자. 원핵생물과 달리, 진핵생물의 DNA에는 엑손(Exon)과 인트론(Intron)이 있다. 전사 과정은 엑손과 인트론을 구분하지 않고 모조리 전사하는데, 엑손만이 단백질에 대한 '진짜' 정보를 담고 있기 때문에 인트론은 단백질로 번역되기 전에 제거할 필요가 있다. 이 과정을 RNA 가공이라고 하고, 인트론이 제거되지 않은 상태의 RNA를 pre-RNA라고 한다. 즉 RNA 가공이란 pre-mRNA를 splicing을 해서 성숙한 mRNA로 만드는 과정이다. 여기에는 5' capping[16], splicing(이어맞추기)[17], 3' 폴리아데닐화(polyadenylation)[18] 총 세 과정이 있다.
그렇다면 왜 RNA 가공이 지금 나오나요? 그건 RNA의 가공이 전사 신장과 동시에 진행되기 때문이다. 그래서 Co-transcriptional splicing이라고도 불린다. 여기서도 원핵생물과의 차이가 나오는데, 원핵생물은 전사와 번역을 동시에 한다.(Co-transcriptional translation) RNA의 가공 인자 역시 PolⅡ의 CTD 꼬리를 이용하며, 그 중 Ser의 인산화를 마커 삼아서 결합을 한다. CTD 꼬리는 중합효소가 합성한 RNA가 나오는 통로에 가깝게 위치해있기 때문에, 전사와 동시에 바로바로 가공이 이뤄질 수 있다. 꼬리의 몇번째 세린이 인산화되냐에 따라 달라붙는 가공 인자가 다른데, 보기 좋게 표로 나타내면 다음과 같다.
| 5번 Ser | YSPTSPS | capping 인자 |
| 2번 Ser | YSPTSPS | splicing 인자 |
4.3.1.1 5' capping
mRNA의 5' 말단에 메틸화된 구아닌(G)가 결합한 것을 5' cap이라고 한다. 아까 언급된 P-TEFb라는 전사인자가 hSPT5라는 단백질을 활성화시키면, CTD 꼬리의 인산화된 5번 세린에 hSPT5가 다가가서는 5' capping 효소들을 모은다. 아까 5번 세린이 인산화되어 polⅡ를 프로모터에서 탈출시킨다고 한 것을 기억하는가? 그렇다. 우리의 세포는 5번 세린의 인산화를 공유시켜서, 전사가 신장되자마자 5' 말단에 capping을 하는 갓갓갓한 방법을 사용한다. RNA 이어맞추기를 위해 2번 세린이 인산화될 때, 이미 인산화되어 있던 5번 세린이 탈인산화 되는데, 이 때 5' capping 효소가 꼬리에서 분리되어 기능을 수행한다.
5' capping 효소들의 좀 더 디테일한 작용 과정은 다음과 같다.
p는 인산기고, 왼쪽부터 γ, β, α 다.5'-pppN-p-N-p-N-ㆍㆍㆍ-N-p-3'1. 먼저 5' 말단은 NTP[19]라는, 염기에 인산기가 3개(α, β, γ) 붙은 형태를 하고 있다.
Gppp + ppN-p-N-p-N-ㆍㆍㆍ-N-p-3' + [math] p_{i} [/math]2. RNA triphosphatase가 5' 말단의 γ[20]-인산기를 분리시킨다. 이는 감마-베타-알파 순으로 노출되어있기 때문.[21]
GpppN-p-N-p-N-ㆍㆍㆍ-N-p-3' + [math] pp_{i} [/math]3. Guanylyltransferase에 의해 GTP[22]가 첨가된다. 그런데 그대로 첨가되면 GTP의 α, β, γ와 NTP의 β, γ 총 5개의 인산기가 연결되는 셈인데, 실제로는 GTP의 효소와 복합체를 이루기 전에 β, γ 인산기가 떨어져나가 GMP가 된다. 그리고 GMP의 α 인산기와 NTP의 β가 결합한다.
[math] m^7 [/math]GpppN-p-N-p-N-ㆍㆍㆍ-N-p-3'4. Methyltransferase(메틸전달효소)가 G의 2번 탄소에 메틸기를 추가한다.
4.3.1.2 이어맞추기
각종 인자들에 의해, 인트론이 제거된 후 엑손들이 조합된다.
자세한 것은 RNA splicing 참고.
4.3.1.3 3' 폴리아데닐화
3'말단 폴리아데닐화는 전사가 종결될 즈음 해서 발생한다. 말 그대로 마지막으로 나온 mRNA에 poly-A 꼬리를 붙이는 것이기 때문이다. poly-A란, 아데닌(A)이 연속적으로 있는 서열(AAAAAAAA...)을 말한다.
DNA에는 poly-A-신호 서열이 있다. polⅡ가 이 서열이 전사된 mRNA가 CTD 꼬리 근처로 나오게 되면, 꼬리에 붙어있던 CstF[23]와 CPSF[24]가 전사된 서열에 결합한다. CsTF에 의해 mRNA가 절단되고 실질적으로 mRNA가 완전히 떨어져나와 전사가 종결된 상태가 된다.[25]
그다음으로 poly-A-중합효소(PAP)가 mRNA에 결합한 CPSF를 인식, 3' 말단에 A를 계속계속 첨가한다. 언제까지 첨가하나요? 아직 아무도 모른다. 대충 200개 정도의 A가 첨가되는데, 항상 그런건 아니다. A가 몇개 첨가되는지는 poly-A에 결합하는 단백질들이 결정하는 것으로 보인다. PAP는 다른 중합효소와 달리 주형(template)이 필요없으며, A를 엄청 첨가하는 만큼 ATP가 엄청 쓰인다.
poly-A 서열은 RNA에서만 발견되고, 또 polⅡ에 의한 전사에서만 발견된다. 뭐 덕분에 단백질을 코딩하는 mRNA를 분리할 수 있긴 하지만...[26] 아마도 mRNA를 통제하기 위한 마커로 쓰이는 것으로 추측된다. 즉 mRNA라는 것을 인식할 수 있는 이름표인 것.
이렇게 3' 말단 폴리아데닐화까지 끝마친 성숙한 mRNA는 핵 밖으로 나가서 번역된다. 물론 여기서 전사가 끝난 게 아니다. CstF가 mRNA를 자르긴 했지만, polⅡ는 아직 DNA에 결합해서 계속 외로이 전사를 하고 있다. 이 눈치없는 녀석이 DNA에서 완전히 떨어져 나가야만 전사가 종결된다.
4.4 종결
폴리아데닐화가 끝나면 전사의 종결로 이어지는데, 아쉽게도 그 과정은 명확하게 밝혀지지 않았다. 다만 두 가지 모델이 제시되고 있다.
4.4.1 어뢰(Torpedo) 모델
폴리아데닐화가 끝난 후에도 polⅡ가 전사를 계속하지만, 이 때 전사되는 RNA는 5' cap이 없다. polⅡ의 꼬리에는 Rtt103[27]이라는 단백질이 결합해 있고, 이 녀석은 RNA 끝에 5'-to-3' RNase를 끌어모은다.[28]. RNase는 5' cap이 없는 RNA를 인식해서 분해를 시작한다. 그런데 polⅡ가 계속 전사를 하고, RNase는 그걸 분해한다면 전사가 종결되는 게 아니라 끝없는 추격전만 이어지지 않을까? 다행히도 세포는 우리 생각보다 똑똑하다. RNA 분해 속도가 전사 속도보다 빠르기 때문에, 시간이 지나면 결국 RNase와 polⅡ가 부딪히게 된다. 확실치는 않으나 이 물리적인 충돌로 인해(어뢰를 쏜 것 처럼) polⅡ가 DNA에서 분리되는 것으로 보인다. 하지만 실험실해서 인공적으로 시도를 해보면 Rat1만으로 분리가 잘 안되는데, 분리 과정에 다른 단백질이 관여하기 때문일 수 도 있다.
4.4.2 알로스테릭(allosteric) 모델
단백질에 대해 공부를 했다면, 알로스테릭이라는 말을 들어봤을 것이다. '알로스테릭한 특성'이란, 효소의 활성부위가 아닌 곳에 뭔가가 결합하면서 효소의 모양이 변화는 것을 의미한다. 효소의 모양이 변화한다는 것은, 기질(혹은 전이 상태)에 대한 효소의 특이성(specificity)가 떨어진다는 것이고 곧 효소 기능의 변화를 의미한다.
전사 종결의 알로스테릭 모델은 다음과 같다. 폴리아데닐화가 끝나면 뭐 때문인지는 모르겠지만(...) polⅡ의 모양이 변해서 DNA에 더 이상 결합할 수 없게 되어 알아서 떨어져나간다. 이 형태변화는 폴리아데닐화 자체에 의한 것일 수도 있고, 다른 단백질 때문일 수도 있다.
4.5 RNA 중합효소 Ⅰ, Ⅲ
polⅠ과 polⅢ는 각각 polⅡ와 다른 프로모터를 인식하고, 다른 종류의 전사 인자들을 이용한다. 근데 전사인자들의 구조나 기능 자체는 pol의 종류에 관계없이 비슷한데, 대표적으로 다음과 같은 것들이 있겠다. 가로 줄에 있는 단백질들이 기능과 구조가 비슷한 집단.
| polⅠ | polⅡ | polⅢ |
| A49/34.5 | TFⅡF | C37/53 |
| TAF1B | TFⅡB | Brf |
TBP는 모든 중합효소가 공통적으로 사용한다.
4.5.1 RNA PolⅠ의 전사
PolⅠ은 리보솜을 구성하는 RNA, 즉 rRNA를 전사하는 중합효소다. polⅠ이 주형으로 삼는 DNA는 중심 프로모터와 그 앞에 있는 UCE(upstream control element)로 구성된다. 사람의 경우 UCE에 UBF 이합체가 결합하면, 중심 프로모터에 SL1가 결합해[29] polⅠ를 데려와 전사를 시작한다. SL1은 TBP와 TAF(TBP-associated factor)를 구성하기 때문에 개시전복합체를 만들 수 있다.
세포 안에는 rRNA 정보를 담은 DNA 복제본들이 많이 존재하고, 그만큼 rRNA의 발현량도 높다. rRNA만을 위해 polⅠ이 따로 존재하는 것은 이와 관련이 있을지도 모른다.
4.5.2 RNA PolⅢ의 전사
PolⅢ는 tRNA와 일부 sRNA, rRNA를 전사한다. tRNA를 전사할 때는 TFⅢB와 TFⅢC가 전사인자로, rRNA(5S)를 전사할 때는 TFⅢA 또한[30] 전사 인자로 이용된다.
polⅢ가 전사하는 DNA의 프로모터는 TATA박스를 가지는 것부터 BoxA,B,C까지 꽤 다양한데, 보통 중합효소에 의해 전사가 시작되는 지점보다 아래 쪽에 프로모터가 있다. 효모의 tRNA 유전자는 전사개시점 하류에 BoxA와 BoxB를 가진다. TFⅢC가 Box들을 인식해서 프로모터 자리에 결합하게 되면, TFⅢB(및 TBP)가 upstream의 전사개시점에 모이게된다. 곧 polⅢ의 결합이 유도되어 전사가 진행된다. polⅢ는 전사하면서 부딪히는 TFⅢC를 분리시키는 것으로 보인다.
5S rRNA는 프로모터가 BoxA와 BoxC로 이루어져 있는데, BoxA에 TFⅢA가 추가로 결합한다.- ↑ 단백질 정보를 담고 있지 않은 DNA 부분
- ↑ 유전자(gene)는 어떤 아미노산으로 단백질을 만들지에 대한 정보를 담고 있는 염기서열을 말한다. 즉 프로모터는 유전자가 아니라, 유전자의 조절부위 중 하나다.
- ↑ 보존되어 있다는 것은, 약간의 염기에서만 차이가 나고 거의 같다는 소리다
- ↑ (-)를 upstream이라고 표현한다.
- ↑ 대장균의 Gal 유전자가 그렇다
- ↑ 유감이지만 extended-10, discriminator, UP-element는 마땅한 한국어 번역명이 없다.
- ↑ 리보솜을 구성하는 RNA
- ↑ 즉 전사과정에서 DNA는 -10자리부터 분리되는 것이다
- ↑ 염기가 중합되려면 중합효소의 활성부위가 주형(template)의 다른 염기로 이동해야 한다.
- ↑ 각 가설의 한글 명칭은 임의 번역임에 주의. 참고로 이 가설들의 이름은 번역된 바가 없다.
- ↑ 35자리, -10자리 다
씹고무시하고 앞뒤로 이동하니까 - ↑ 위의 예시에서 AGA랑 TCT가 접혀서 결합하다고 생각하면 된다
- ↑ 이 때, 고등생물일수록 반복 수가 많다.
- ↑ P-TEFb가 인산화(=활성화) 시키는 TAT-SF1, hSPT5는 후술할 RNA 가공에서 활약한다.
- ↑ 그렇기에 오히려 뉴클레오솜을 더 단단히 응집시켜서 전사를 억제하는 기전도 있다.
- ↑ mRNA 5' 말단에 모자를 씌우기
- ↑ 인트론 제거하기
- ↑ mRNA 3' 말단에 polyA 붙이기
- ↑ 여기서 N이란, A/C/T/G 중 아무거나 라는 뜻
- ↑ 감마
- ↑ 바꿔말해서 감마가 인산화 꼬리의 가장 끝 부분.
- ↑ GTP의 G가 곧 구아닌이다. 이건 ATP 참고
- ↑ cleavage stimulation factor
- ↑ Cleavage and polyadenylation specific factor
- ↑ 물론 아직까지 완벽히 종결된 게 아니다.
- ↑ 친화(affinity) 크로마토그래피로 분리한다.
- ↑ 효모에서 발견된 단백질
- ↑ RNase는 사람의 경우 Xrn2, 효모는 Rat1
- ↑ 반드시 UBF가 먼저 결합한 상태여야 한다.
- ↑ B,C 포함