1 개요


Structural isomer, Constitutional Isomer
광학 이성질체나 기하 이성질체의 경우와 달리 구조 자체가 판이한 경우이다. 즉, 분자를 구성하고 있는 원자의 종류와 그 개수가 같아 분자량은 서로 동일하지만, 원자 사이의 결합 순서나 결합차수 등이 달라 화학적[1], 물리적 성질[2]이 다르게 나타난다.
이처럼 나타내는 구조 자체가 아예 다르므로 IUPAC 명명법도 기하 이성질체나 광학 이성질체는 앞에 붙는 접두어만 다른 반면, 구조 이성질체는 이름 자체가 완전히 다르다.[3][4]
2 분류
모든 이성질체가 그러하듯 원소 기호와 숫자만으로는 구별하지 못하므로 별별 복잡한 화학식을 양산하게 되는 주범으로 꼽힌다. 다만 접두사가 없을 경우 식이 완전하게 동일해지는 광학이나 기하 이성질체와 달리 대부분의 구조 이성질체는 단순히 시성식으로도 구분이 가능[5]하기 때문에 별 문제는 없다. 그나마 접두어를 사용해가며 이성질체로 분류해주는 게 아래에 설명할 사슬 이성질체(Chain isomer)와 위치 이성질체(Position isomer). 정의가 애매하기 때문에 편의상 사용하는 구분이다.
중등교육과정인 화학Ⅰ, 화학Ⅱ 수준에서 다룰 법한 떡밥으로, 구조이성질체를 죽입시다 구조이성질체는 우리의 원수 대학 레벨까지 갈 경우 구조 이성질체를 애초에 서로 다른 화합물이라 인지하고 있기 때문에 별다른 의의를 두지 않는다.[6] 구조 차이에 따른 물리적, 화학적 성질의 차이만 언급하는 정도.
2.1 사슬 이성질체



- n-Pentane, iso-Pentane, neo-Pentane
분자를 구성하는 원자 간의 결합 순서가 다른 경우 혹은 결합의 개수가 다른 경우이다. 주로 탄소 사슬에서 나타나며, 상용명에서는 n-, iso-, neo-의 접두어를 사용하여 구분한다. 그림에 나타난 세 펜테인은 모두 C5H12의 동일한 화학식을 가진다.
화학식과 몰질량은 동일하지만, 그 외의 성질에서 차이가 나기 때문에 반데르발스 힘과 같은 분자 간 인력을 다룰 때, 유기 반응이나 합성에서 주로 사용된다.
2.2 위치 이성질체

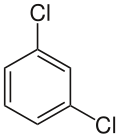
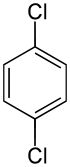
- ortho-Dichlorobenzene, meta-Dichlorobenzene, para-Dichlorobenzene
벤젠 고리에서 두 개의 치환기가 존재할 때, 치환기의 위치에 따라 나타나는 구조 이성질체이다. 하나의 치환기를 기준(1번 자리)으로 삼고 다른 하나의 치환기가 2번 자리(ortho-, o-), 3번 자리(meta-, m-), 4번 자리(para-, p-)에 위치할 때 접두사가 바뀌게 된다. 이성질체를 보다 명확하게 표현하는 IUPAC 명명법에서는 1,4-Dichlorobenzene과 같이 앞서 설명한 자리의 번호를 붙여주는 것으로 해결한다. 간단한 화합물로 비교해서 그렇지 복잡해지면 답도 없다
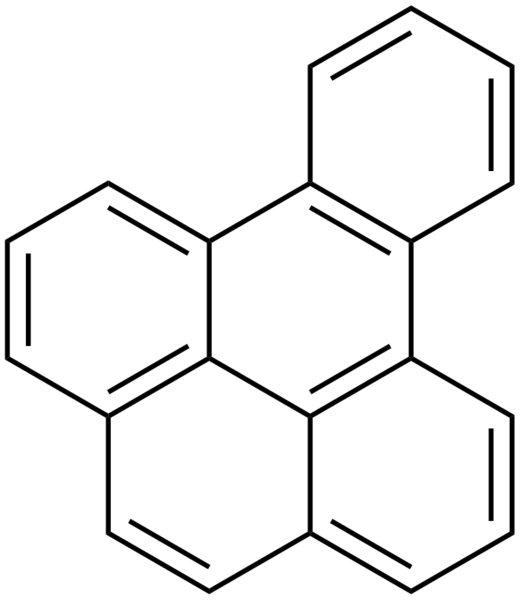 |  |
| Benzo[e]pyrene | Benzo[a]pyrene |
| 벤조피렌 | |
다중고리 방향족 화합물에도 쓰이는데, 여기에도 작명에 일정한 규칙이 있다.