- 상위 문서: 생물학 관련 정보
목차
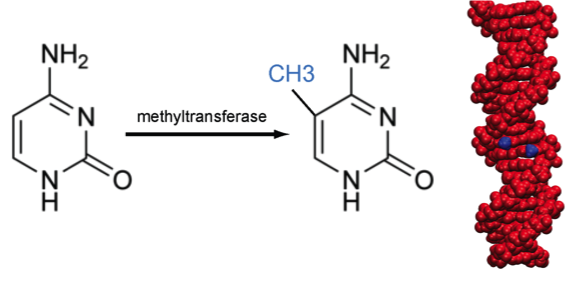
1 개요
진핵세포 생물체가 유전자 발현을 조절하는 방법 중 하나. 유전자의 프로모터 부위에 많이 분포하고 있는 CpG[1][2]의 사이토신 염기에 메틸 잔기를 갖다 붙여 그 유전자의 전사를 막음으로 [3] 그 발현을 저해하게 된다.[4] 1948년 롤린 호치키스(Rollin Hotchkiss)가 송아지 가슴샘에서 처음 발견하였다. 대부분의 식물, 동물, 균류에서 볼 수 있는 조절기능으로 쓰이지 않는 유전자, 비활성화된 X 염색체 등이 많이 메틸화되어 있는 것을 관찰할 수 있다. 몇몇 종의 배아 발생에 중요한 역할을 하고 있는 듯하다. 난자는 받아들인 정자의 DNA 메틸화를 무효화시켜 DNA를 원래 상태로 되돌리는 기능이 있다고 알려져 있다. 난자가 배아줄기세포 제작에 사용되는 것도 그러한 특성 때문이다. 특이한 점은 세포 분열 이후에도 메틸화 부위가 정확하게 유지된다는 것으로 변화를 기록하는 역할을 수행한다. 이를 이용하여 모계, 부계 대립 유전자를 조절하는 유전체 각인에도 기여한다. 메틸화가 잘 일어나는 부위로는 CpG가 있다. 사이토신 잔기는 메틸화되면 자발적으로 티민으로 변화하려는 경향성이 있기 때문에 인간 DNA 중 CpG의 비율이 예상[5]과는 달리 1%로 매우 낮다.
여담으로, 쌍둥이 둘의 DNA 메틸화 정도를 비교한 연구에서 DNA 메틸화는 후천적으로 결정될 수도 있다고 한다.
1.1 비정상적 DNA 메틸화로 인한 질병
앞서 설명했듯이, DNA 메틸화는 유전자의 발현에 깊게 관여되어 있어 만약 잘못되었을 경우 질병으로 이어질 수 있다. 아래는 그에 대한 설명이다.
1.1.1 암
유전자의 발현을 조절한다는 점에서 DNA 메틸화는 암과도 연관이 깊다. 세포는 당연히 그 자신의 세포분열을 조절해야 할 필요가 있으므로 세포는 자신의 세포분열을 조절하는 기작을 가지고 있다. 그런데 DNA 메틸화에 문제가 생겨 그 기작에 관여하는 어떤 효소 하나가 과하게 생성되거나 적어지게 되고 그로 인해 세포가 그냥 분열하게 된다면? 그리고 DNA 메틸화는 또 체세포 복제 시 그대로 유지되기 때문에 이 같은 과정은 한번 생기면 계속 반복되게 된다. 또한 DNA 메틸화가 과도하게 일어나게 되면, 전에도 말했듯이 메틸화된 사이토신은 티민으로 변해 점 돌연변이가 일어날 확률이 매우 높아지므로, 이로 인한 돌연변이로 암이 발생할 수도 있다.
암세포를 관찰한 연구에 따르면, 암세포에서 나타나는 비정상적인 메틸화로는 두 가지 유형이 있음을 알 수 있다. 첫째, 전체적인 저메틸화(Hypomethylation)[6], 둘째, 특정 부위(CpG island)의 과메틸화(Hypermethylation)[7]. 메틸화는 유전자의 발현 정도를 조절하므로 비정상적인 메틸화가 세포분열 주기에 영향을 미쳐 암을 발생시키는 원인으로는 암 유발 유전자(주로 세포분열 촉진 역할)의 과활성화, 암 억제 유전자(주로 세포분열 저해 역할)의 비활성화, 혹은 세포분열 주기를 관리하고 있는 시스템의 균형을 무너뜨려 암을 발생시키는 것으로 세 가지가 있을 수 있다. 연구 결과에 따르면 암 유발 유전자의 활성화에 대한 영향보다는 암 억제 유전자의 비활성화에 대한 영향이 크다고 한다.[8][9]
1.1.2 동맥경화증
모든 경우의 동맥경화증에 DNA 메틸화가 관여하는 것은 아니지만, DNA 메틸화 이상은 동맥경화증을 가져올 수 있다. 비타민 B6, B9, B12의 결여 혹은 유전적 요인으로 호모시스테인(homocysteine)의 혈액 내 농도가 진해져 고호모시스테인혈증(hyperhomocysteinemia)이 오게 된다. 그러면 DNA 저메틸화가 나타나게 되고[10], 이로 인해 표피세포는 계속 증식하게 되며 염증을 유발하는 물질을 생산해내어 병변이 생기게 된다. 이 병변이 계속 쌓이게 되면 결국 혈관을 막게 되고 동맥경화를 초래한다.
고호모시스테인혈증은 또한 에스트로겐 수용체 α 유전자의 과메틸화를 일으킨다.[11] (에스토로겐 수용체 α는 성장을 억제하는 기능을 가지고 있다.) 이도 고호모시스테인혈증이 동맥경화를 초래하게 되는 한 요인 중 하나라 할 수 있을 것이다.
1.2 노화와 DNA 메틸화
나이가 들면 들수록 DNA가 메틸화된 정도가 점점 적어진다고 한다.[12] 하지만 에스트로겐 수용체 등 몇몇 유전자의 DNA는 그 반대라 한다.
1.3 B세포의 분화
B세포는 체내로 들어오는 모든 항원에 대해 대비해야 하기 때문에 세포마다 랜덤하게 다른 항체를 생산해내는 메커니즘을 갖고 있다. 이 메커니즘의 앞부분에 DNA의 저메틸화가 관여한다고 한다.
1.4 근육에서의 DNA 메틸화
과격한 운동 후, 미토콘드리아의 재생산을 촉진하는 단백질과 젖당의 분해를 담당하는 단백질의 유전자의 DNA가 저메틸화된다고 한다. 과격한 운동 후 근육의 기능을 회복하고 강화하는 것이기 때문에 어찌보면 당연한 것.[13]
오랫동안 운동한 사람에게서는 지방 조직의 DNA 메틸화 정도가 늘어난다고 한다.
1.5 후성유전학에서의 DNA 메틸화
최근 진화생물학과 관련되어 각광을 받고 있는 후성유전학에서 중요한 의의를 가지는 개념이다. 세포가 분열을 계속하다 보면 메틸화가 되어 쓰이지 않는 유전자가 생기기 때문에 세포들의 기능에 차이가 있는 것이라고 생각된다. 이렇듯 유전자 자체는 같지만 발현에 차이가 생기는 것을 연구하는 것이 후성유전학이다. 후성유전학에 영향을 미치는 또다른 효과로는 히스톤 수식이 있다. 히스톤 수식은 히스톤에 감겨진 DNA를 풀 수 없게 만들어 해당 유전자가 발현되지 않게 만든다.
1.6 미생물에서의 DNA 메틸화
박테리아는 자신의 제한효소 작용으로부터 스스로의 게놈을 보호하기 위하여 특정부위의 A나 C염기를 메틸화 시킨다. 또한 특정 세포로의 분화과정에서도 자발적인 메틸화가 일어나는데, 그 정확한 기작은 밝혀지지 않았다.- ↑ 5'-C-phosphate-G-3'
- ↑ 다른 곳보다는 특히 이곳에 쏠려 나타난다. 이를 CpG island라고 한다.
- ↑ 물론 물리적인 배리어로서의 역할도 하지만 그게 다가 아니다. 이 부위에는 MBD(methyl-CpG-binding domain) 단백질이 달라붙게 되는데, 이는 히스톤 탈아세틸화효소와 염색질의 구조에 관여하는 여러 단백질들을 끌어들인 후 염색질을 압축시켜 헤테로크로마틴(heterochromatin)으로 만들어 결과적으로 그 부위와 그 주변 부위까지의 DNA의 전사를 저해하게 된다.
- ↑ DNA를 메틸화하기 위해 쓰이는 효소는 DNA methyltransferase(DNA MTase)이다.
- ↑ 1/16, 약 6%
- ↑ Feinberg AP, Vogelstein B. Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature 1983; 301: 89–92.
- ↑ Baylin SB, Hoppener JW de B, Steenbergh PH, et al. DNA methylation patterns of the calcitonin gene in human lung cancers and lymphomas. Cancer Res 1986; 46:2917–2922.
- ↑ Laird PW, Jackson-Grusby L, Fazeli A, et al. Suppression of intestinal neoplasia by DNA hypomethylation. Cell 1995; 81: 197–205.
- ↑ Herman JG, Umar A, Polyak K, et al. Incidence and functional consequences of hMLH1 promoter hypermethylation in colorectal carcinoma. Proc Natl Acad Sci USA 1998; 95: 6870–6875.
- ↑ 이 과정에 대해 자세히 알기 위해서는 SAM(S-Adenosylmethionine)과 SAH(S-Adenosylhomocysteine)사이의 관계에 대해서 알아야 한다. SAM은 아데노신의 5번 탄소 자리에 메티오닌의 황 원자가 결합한 꼴이고 SAH는 똑같이 아데노신의 5번 탄소 자리에 호모시스테인의 황 원자가 결합한 꼴이다. 구조식을 보면 알겠지만 SAM이 SAH의 황 원자에 메틸기가 붙은 모양이다. 여기서 이미 알아챈 사람도 있겠지만 SAM은 세포내 메틸화 과정에서 메틸기를 공여해주는 역할을 하고 SAH는 그 반대 작용을 한다. 따라서 만약 다른 모든 조건이 동일하다면 세포내 메틸화 과정은 SAM과 SAH의 비율에 영향을 받는다.
- ↑ 에스트로겐 수용체 α 외 몇몇 유전자에는 다른 유전자와는 반대 작용을 나타낸다.
- ↑ Heyn, Holger; Li, Ning; Ferreira, Humberto J.; Moran, Sebastian; Pisano, David G.; Gomez, Antonio; Diez, Javier; Sanchez-Mut, Jose V.; Setien, Fernando (2012-06-26). "Distinct DNA methylomes of newborns and centenarians". Proceedings of the National Academy of Sciences 109 (26): 10522–10527.
- ↑ 그저 이 유전자의 조절 방식이 DNA 메틸화인 것뿐이다.