한자: 渗透[1]
문화어: 스밈현상
영어: Osmosis
독일어: Osmose
1 개요
서로 다른 농도를 가진 두 액체를, 용매는 통과시키나 용질을 통과시키지 않는 반투과성막으로 막아놓았을 때, 농도가 낮은 쪽에서 높은 쪽으로 용매[2]가 이동하는 현상을 삼투 현상이라고 하며, 이 현상으로 생기는 압력을 삼투압이라고 한다.
하이탑이나 대부분의 인강 사이트들이 잘못 설명하고 있는 게 있는데, "주로, 삼투 현상이 일어나는 원인은 액체간 농도 차이를 줄이기 위함" 이라고 설명하지만 이는 틀린 말이다.[3] 삼투 현상이 일어나는 원인은 액체간 압력 차이이다. 액체들의 농도 차이가 줄어드는 것은 그 결과이다.
용매 분자들은 크기가 작아서 반투막을 통과할 수 있다. 그리고 용질 분자들은 아무리 크기가 작더고 하더라도 용매분자들이 녹이기 위해 주위를 둘러싸기 때문에 크기가 커질 수밖에 없다. 가령 물을 예시로 들자면 물 분자들은 NaCl이나 설탕 분자들을 수화시키기 위해 그들을 둘러싼다. 그렇기 때문에 아무리 용질의 분자 크기가 작아도 반투막을 통과하기 어려운 것이다.
이 때 용매 분자들은 반투막을 통과할 뿐만아니라 반투막과 충돌을 한다. 이때 수용액에서는 (쉬운 설명을 위해 용매를 물, 용질을 설탕으로 가정하자)물 분자들이 설탕을 수화 시키기 위해서 둘러싸고 있다. 그렇기 때문에 농도가 높을수록 녹아있는 설탕의 분자 수가 많아, 그것들을 둘러싸는데 소진되는 물 분자 수가 더 많아질 것이다. 따라서 농도가 높을수록 자유로워지는 물 분자의 개수가 줄어들고, 반투막에 충돌하는 횟수도 줄어들어 상대적인 압력도 줄어들 것이다. 즉, 삼투현상에서 생기는 높이차 h는 압력차 때문에 생기는 것이다.
그렇기 때문에 삼투 현상은 아무런 에너지를 투입하지 않아도 농도의 차이만 있다면 화학적으로 안정적인 상태에서 저절로 일어나는 현상이다. 용액에 삼투압보다 큰 에너지를 투입하면, 용매가 높은 농도에서 낮은 농도 쪽으로 이동하게 되는 역삼투 현상이 일어나기도 한다.[4]
1.1 삼투압
Osmotic Pressure
앞서 말하였듯, 삼투 현상으로 인해 생긴 압력을 말한다. 반트 호프가 세운 식은 다음과 같다.
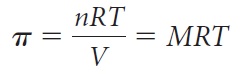
(π = 삼투압[5], n = 부피당 몰수, R = 기체 상수, T = 절대 온도, V = 부피, M = 몰농도)
이상용액[6]이라는 가상의 용액을 기준으로 쓰여졌다. 이상 기체의 상태방정식 PV=nRT에서 유도가능한 식이다.(사실 물리화학에서 유도하는 과정은 이렇게 간단하지 않지만, 묽은 용액이 기체와 같은 성질을 나타낸다는 것을 표현하는 데에는 부족함이 없다)
1.2 수동 수송
Passive Transportation
세포 내외에서 외부 에너지의 개입없이 농도 차이 만으로 물질이 이동하는 체내 삼투 현상이다. 보통 특정 물질의 농도가 높은 쪽에서 낮은 쪽으로 일어나지만, 물질이 갖고 있는 전하의 차이로 인한 전위차로 일어나기도 한다. 전자는 주로 세포막을 통한 물질의 이동, 후자는 주로 ATP의 합성시에 일어난다.
수동수송과 반대로 에너지 투입 등으로, 농도 차이를 극복하여 체내 물질이 이동되는 현상은 능동수송이라고 한다.
2 삼투현상의 예
- 달팽이에게 소금을 뿌리면 삼투 현상에 의해 몸에 있던 수분이 밖으로 다 빠져나와 죽게 된다.
- 적혈구를 농도가 진한 고장액(hypertonic)에 담가 놓으면 수분이 밖으로 빠져나가 쪼그라든다. 반대로 농도가 묽은 저장액(hypotonic)에 담가 놓으면 수분이 적혈구로 들어와 결국 터지는 용혈 현상이 일어난다. 따라서 용액을 혈관에 주사할 때, 등장액(istonic)을 사용해야만 한다. 농도가 혈액보다 진하거나 묽으면 조직이 괴사 할 수 있다.