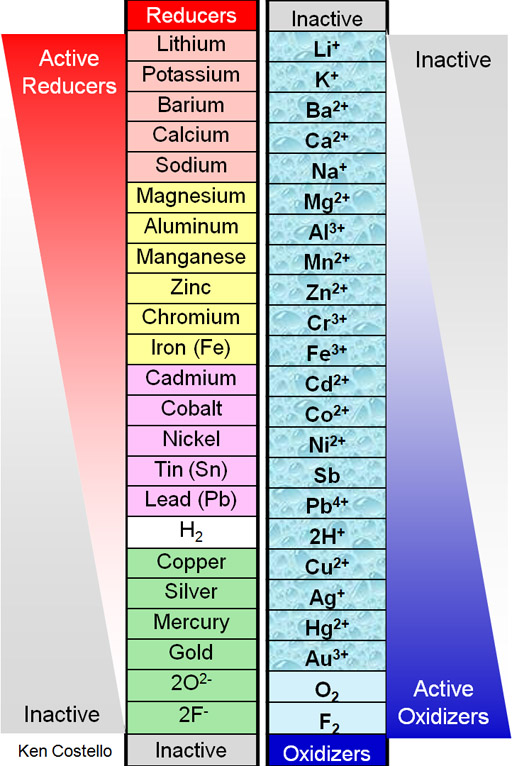
그림 틀렸다!!!! 수은과 은의 위치가 바뀌어져 있다. 또 주석이 Sb가 아니라 Sn 2+ 이다.
리튬>칼륨>바륨>칼슘>나트륨>마그네슘>알루미늄>망가니즈>아연>크롬>철>카드뮴>코발트>니켈>주석>납>수소>구리>수은>은>백금>금
참 정성이야
화학 용어로서, 원자 또는 분자가 이온이 되려고 하는 경향을 뜻한다. 금속의 반응성이라고도 한다. 대한민국에서 화학Ⅰ과 화학Ⅱ를 공부하는 고등학생이라면 주기율표 20번까지와 함께 거의 필수적으로 외워야 하는 것.
줄여서 리칼카나마알아철니주납수구수은백금. 또한 쉽게 외우는 연상암기 법은, 니칼가나망알연(니칼가냐?망할년) 뒤에는 다시 원치 대로 가는 방법이 있다. 다만 리튬은 고등학교 화학에서는 자주 빠진다. 그리고 축약어가 겹치는 금속 원소도 있으니 주의.[1]
수소는 금속이 아니지만 들어있는 이유는, 보통 수소를 기준점으로 많이 삼기 때문이다. 수소는 물질로서의 금속은 아니지만 전자를 버리면서 반응하는 모습은 금속 원소가 반응하는 과정과 동일하기 때문. 수소보다 이온화 경향이 높을 경우에는 묽은 산에 녹아 이온화되고, 산 속의 수소 이온이 전자를 얻어 수소 기체로 변한다. 수소보다 이온화 경향이 낮은 금속들은 묽은 산과 잘 반응하지 않는다. 즉, 전자를 내놓지 않기 때문에 산성용액에서 쉽게 녹지 않는다. 그래서 금(Au)을 녹이려면 산성용액 중에서도 왕수라고 불리는 용액을 사용해야한다.(그렇다고 왕수가 강산이라고 생각하면 오산! 자세한 것은 왕수를 참조)
왼쪽으로 갈수록 녹이 잘 슨다고 보면 된다. 다만 일부 금속은 녹이 피막을 형성하여 안쪽까지 산소가 침투하지 못해 표면만 녹이 슬고 더는 진행되지 않거나 아주 느리게 녹이 스는 경우도 있다.[2]
이온의 가수가 낮은 알칼리 금속과 알칼리 토금속의 이온화 경향이 가장 높다. 이온화 결합으로 이루어진 분자들은 다른 분자들 (수소 결합, london dispersion)에 비해 결합 간에 결합력이 더 강하다. 때문에 끓는 점이 더 높다. 참고로 이온화 에너지가 가장 큰 원소는 He F (Fluorine)이다. 원소주기율표에서 오른쪽 위로 갈수록 커지는데 그 정점이 F. 바로 옆의 비활성 기체는 전자가 들어갈 자리가 없어서 일반적으로는 반응성이 없다.
모 축구 웹툰 작가의 닉네임과 관련이 있다. 이말년도 만화 소재로 쓴 바 있다. 하이탑밴드라는 밴드에서 탄단지[3]라고 해서 과학에 관련된 여러가지 암기법을 노래로 부른 것이 있는데 거기에도 당당히 수록되어 있다. (...)
관련항목 : 금속, 녹, 화학Ⅰ, 화학Ⅱ